
Сарепта отклонила запрос FDA на прекращение приема элевиди после трех смертей
Sarepta Therapeutics Inc. отклонила запрос Управления по контролю за продуктами и лекарствами США о прекращении всех поставок своей генной терапии. Элевиды После трех смертей пациентов, сообщает Bloomberg.
FDA сообщило, что два мальчика-подростка с мышечной дистрофией Дюшенна, оба неспособные ходить, недавно умерли от острой печеночной недостаточности после приема препарата. Элевиды. Кроме того, 51-летний участник исследования другой генной терапии сарепта, направленной на мышечную дистрофию поясницы конечностей, умер в прошлом месяце, также от острой печеночной недостаточности.
Bloomberg пишет, что после этих событий чиновники FDA встретились с Сарептой и попросили компанию добровольно приостановить поставки. Элевидына которые приходится более половины доходов компании от продукции. «Компания отказалась это сделать», — говорится в сообщении агентства.
В своем заявлении в пятницу Sarepta выступила в защиту своего решения продолжить распространение «на основе нашей всеобъемлющей научной интерпретации данных, которая не показывает никаких новых или измененных сигналов безопасности» у пациентов, которые все еще находятся в амбулаторном состоянии.
В июне компания была приостановлена. Элевиды Поставки пациентам без амбулаторных заболеваний. По словам Сарепты, мальчики, которые все еще могут ходить, составляют около 85% тех, кто лечился с момента его запуска.
FDA Комиссар Марти Макари заявил в интервью в пятницу, что агентство рассматривает вопрос о том, будет ли это сделано. Элевиды Они должны оставаться на рынке.
Самая последняя смерть связана с генной терапией, использующей ту же платформу доставки вирусов, что и вирусная терапия. ЭлевидыПредполагая потенциальные более широкие последствия для безопасности. «Мы считаем, что риски того, что FDA полностью удалит препарат с рынка, теперь значительно возросли», — написал аналитик Baird Брайан Скорни в пятницу.
В пятницу около 1:00 вечера. ET, сообщает Reuters со ссылкой на источник, знакомый с этим вопросом, что Управление по контролю за продуктами и лекарствами США попросит Sarepta прекратить все поставки Elevidys. К 1:30 вечера по восточному времени об этом сообщает Bloomberg.
Компания подтвердила третью смерть пациента, связанную с ее программами генной терапии, на этот раз с участием 51-летнего мужчины, который умер в июне от острой печеночной недостаточности после получения исследовательской терапии SRP-9004 для мышечной дистрофии конечностей.
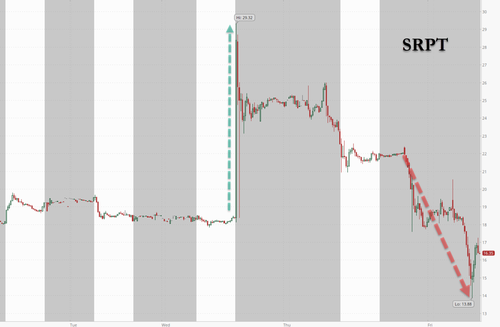
Компания подтвердила смерть BioSpace Об этом широко сообщалось в пятницу утром. Акции Sarepta были ниже примерно на 25% и в конечном итоге закрылись более чем на 30%.
Как и Elevidys — одобренная Сарептой генная терапия мышечной дистрофии Дюшенна — SRP-9004 использует вектор аденоассоциированного вируса (AAV), который компания ранее связывала со смертельными осложнениями печени.
Смерть, о которой не упоминалось во время обновления корпоративной реструктуризации Sarepta ранее на прошлой неделе, привлекла внимание аналитиков.
"" Мы считаем, что смерть пациента LGMD может усилить нерешительность пациента в использовании коммерческих Elevidys и повысить недоверие инвесторов, поскольку компания не раскрыла событие по своему призыву. Уильям Блэр отметил пятницу.
Тайлер Дерден
Мон, 07/21/2025 - 05:45
















